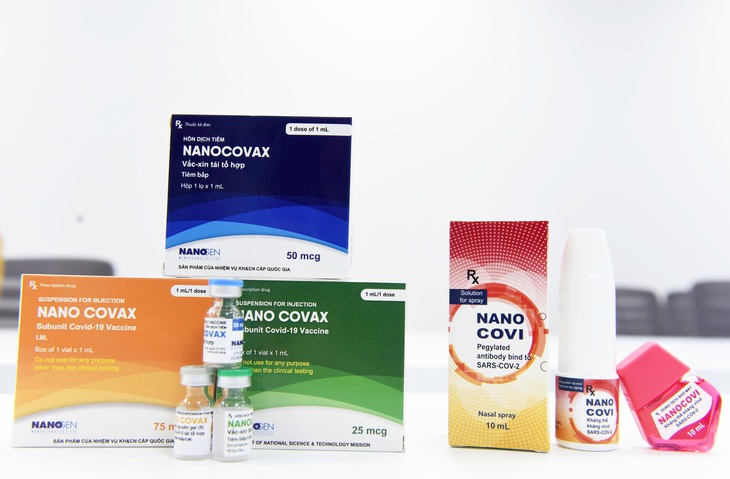
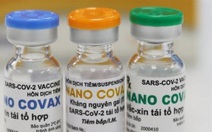
Vắc xin Nano Covax - Ảnh: DUYÊN PHAN
Trả lời tại cuộc họp báo về thử nghiệm lâm sàng với vắc xin Nano Covax, Thứ trưởng Bộ Y tế Trần Văn Thuấn cho hay việc mời người tình nguyện tham gia với tinh thần tình nguyện, vì sự nghiệp nghiên cứu khoa học, phát triển vắc xin của Việt Nam với mong muốn tự chủ vắc xin.
"Hiện vắc xin của Công ty Nanogen chưa thực hiện hết pha 3, mà đang thực hiện giữa pha 3", ông Thuấn thông tin.
Thứ trưởng Bộ Y tế cho biết ngày 22-8 vừa qua, Công ty Nanogen kết hợp các viện nghiên cứu, Học viện Quân y, Viện Pasteur TP.HCM nộp hồ sơ sau khi kết thúc thử nghiệm lâm sàng giai đoạn 3a gửi lên Hội đồng đạo đức, Hội đồng tư vấn cấp phép của Bộ Y tế xem xét cấp phép khẩn cấp đối với vắc xin Nano Covax.
Tuy vậy, vẫn còn một số tồn tại mà Hội đồng tư vấn cấp phép của Bộ Y tế kiến nghị cần thiết giải quyết.
"Về mong muốn, rất mong sớm có nhanh nhất vắc xin, nhưng đây là sản phẩm đặc biệt không những ảnh hưởng một người mà cả cộng đồng và có thể cả nhiều thế hệ, nên chủ trương của Thủ tướng Chính phủ, Bộ Y tế, ta nhanh chóng nhưng phải chặt chẽ, an toàn và hiệu quả", ông Thuấn nói.
Theo ông Thuấn, trên cơ sở kết luận của Hội đồng tư vấn cấp phép, còn ba nội dung công ty và các đơn vị nghiên cứu cần bổ sung và cập nhật dữ liệu:
- Về tính an toàn của tất cả các đối tượng tiêm, các trường hợp sự cố và bất lợi nghiêm trọng;
- Về tính sinh miễn dịch, bổ sung gồm bổ sung cập nhật đánh giá tính sinh miễn dịch trên các biến chủng mới trên biến chủng Delta, biến chủng Anh theo đúng đề cương nghiên cứu đã ban hành;
- Về tính bảo vệ, phân tích và bàn luận mối liên quan tính sinh miễn dịch của vắc xin và tính bảo vệ, để làm sao tối thiểu phải đạt 50% theo khuyến cáo của WHO.
Với trường hợp tiêm đủ 2 mũi vắc xin thử nghiệm, ông Thuấn nói đây là vấn đề Bộ Y tế, Chính phủ bàn sớm với các bộ, ban ngành liên quan, dựa trên các ý kiến nhà khoa học, các ý kiến nội bộ… có đề xuất phù hợp trong thời gian tới.










Tối đa: 1500 ký tự
Hiện chưa có bình luận nào, hãy là người đầu tiên bình luận