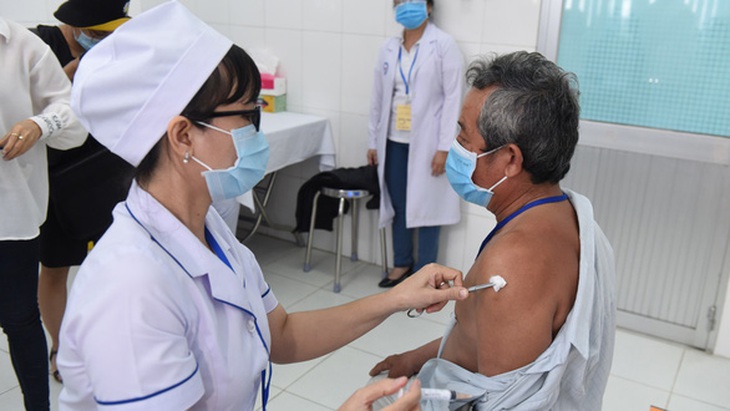
Tiêm Nano Covax cho người tình nguyện tham gia thử nghiệm lâm sàng giai đoạn 2 tại Long An - Ảnh: H.L.
Theo hướng dẫn này, vắc xin sản xuất trong nước đang thực hiện thử lâm sàng nhưng đã có kết quả đánh giá giữa kỳ giai đoạn 3 về tính an toàn, hiệu quả bảo vệ thì có thể xem xét cấp phép có điều kiện, trên cơ sở ý kiến của Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia.
Bên cạnh đó, Bộ Y tế cũng lấy ý kiến tư vấn của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc và tham khảo hướng dẫn của Tổ chức Y tế thế giới.
Vắc xin được cấp phép lưu hành có điều kiện được tiếp tục theo dõi về tính an toàn, hiệu quả, kiểm soát về số lượng, đối tượng, phạm vi sử dụng sau khi được cấp đăng ký lưu hành.
Trường hợp vắc xin đã được cấp phép lưu hành tại ít nhất một nước trên thế giới và có dữ liệu về tính an toàn, hiệu quả, vắc xin chuyển giao công nghệ tại Việt Nam và trước khi chuyển giao công nghệ có dữ liệu lâm sàng về tính an toàn, hiệu quả, được cấp phép tại ít nhất 1 nước trên thế giới có thể xem xét miễn 1 hoặc một số giai đoạn thử lâm sàng.
Nếu vắc xin đã được cấp phép nhưng cần đánh giá thêm về tính an toàn, hiệu quả thì phải thử nghiệm lâm sàng giai đoạn 4 tại Việt Nam.
Về thủ tục cấp giấy lưu hành vắc xin, Bộ Y tế hướng dẫn trong vòng 20 ngày làm việc kể từ khi nhận được đủ hồ sơ, Cục Quản lý dược sẽ cấp giấy phép đăng ký lưu hành vắc xin, trong trường hợp chưa cấp, cục sẽ phải thông báo rõ lý do.
Theo các quy định kể trên, hướng dẫn đăng ký lưu hành vắc xin khẩn cấp đã có nhiều điểm mới so với thông thường, trong đó thông thường vắc xin mới sẽ phải hoàn tất 3 giai đoạn thử nghiệm lâm sàng mới được xem xét cấp phép và phải chứng minh hiệu quả bảo vệ của vắc xin. Với hướng dẫn này, Bộ Y tế cho phép cấp phép sau khi có đánh giá giữa kỳ giai đoạn 3.
Về hiệu quả bảo vệ, cho phép dựa trên tính sinh miễn dịch của vắc xin để đáp ứng yêu cầu về thời gian trong tình hình chống dịch, do theo dõi hiệu quả bảo vệ của vắc xin cần có thời gian.
Tại Việt Nam hiện có 3 vắc xin đang thử nghiệm lâm sàng, gồm 2 vắc xin nội Nano Covax đã nộp báo cáo đánh giá giữa kỳ thử nghiệm lâm sàng giai đoạn 3 lên Bộ Y tế hôm nay 20-8; Covivac vừa bước vào thử nghiệm lâm sàng giai đoạn 2 và Arct-154 (vắc xin chuyển giao công nghệ) vừa bước vào thử nghiệm lâm sàng giai đoạn 1.
Trong trường hợp ứng viên vắc xin đạt yêu cầu về tính an toàn và tính sinh miễn dịch (qua đó đánh giá hiệu quả bảo vệ), Bộ Y tế có thể xem xét cấp phép trong điều kiện khẩn cấp.
Với Nano Covax, sau khi nhận báo cáo đánh giá giữa kỳ thử nghiệm lâm sàng giai đoạn 3, Bộ Y tế và Hội đồng đạo đức trong nghiên cứu y sinh sẽ họp nghiệm thu kết quả giữa kỳ, nếu đạt, nhà sản xuất sẽ nộp hồ sơ đăng ký vắc xin.
Với Covivac và Arct-154, dự kiến sẽ hoàn tất các thử nghiệm vào cuối năm và dự kiến sản xuất chính thức từ năm 2022.













Tối đa: 1500 ký tự
Hiện chưa có bình luận nào, hãy là người đầu tiên bình luận